纤毛是一种突出于细胞表面的细胞器,主要由纤毛膜及其包裹的细胞微管所组成。其非常保守, 在从单细胞生物到人类中都广泛存在。纤毛可分为运动纤毛和不动纤毛。运动纤毛通过摆动来调控细胞的运动,比如纤毛虫的运动。不动纤毛主要参与信号传导,通过纤毛膜上的离子通道或受体感知外界的信号,如物理信号(如液流产生的机械力),化学信号(如气味分子)和生物信号(如多肽hedgehog)等,从而调控动物的生理稳态和发育。纤毛结构或功能的缺陷常导致多种疾病或发育异常,统称为纤毛病(ciliopathies),比如视网膜退化症,骨骼发育异常(如多指/趾症),肥胖,智障,不动纤毛综合征(主要表现为肺部频繁感染,间或内脏翻转,男性表现不育)等。目前新冠病毒所导致的失嗅,很可能是和嗅觉纤毛的功能受损相关,因为嗅觉神经树突上的纤毛是嗅觉的感受器。
真核生物的鞭毛不同于细菌的鞭毛,其具有和纤毛类似的结构和组装机制,为了研究的便利,真核生物的鞭毛也常称为纤毛。衣藻是一种单细胞绿藻,具有两根鞭毛,是纤毛研究的常用模式生物。纤毛突出于胞外,而蛋白质合成在胞质,那么在纤毛组装时,参与纤毛组装的蛋白是如何运输的?上世纪90年代,rosenbaum等首先在衣藻的鞭毛中发现一种双向的蛋白质运输系统,称为“鞭毛内运输”(intraflagellar transport, ift)。该系统非常保守,参与了包括人类在内的几乎所有生物的纤毛组装。ift的机制包括向纤毛顶端运输(正向运输)的驱动蛋白kinesin-ii,向纤毛基部运输(反向运输)的动力蛋白ift dynein以及和马达蛋白相结合的ift蛋白复合物 (见图例)。ift蛋白复合物作为载体装运纤毛组分包括信号分子,其可分离为两个复合物ift-a和ift-b。在正向运输中,马达蛋白和ift蛋白复合物是如何互作的,机制尚不明确。
2020年12月28日,清华大学生科院潘俊敏课题组在embo j杂志上发表文章: ift54与马达蛋白kinesin-ii 和ift dynein直接互作调控正向的“鞭毛内运输” (ift54 directly interacts with kinesin-ii and ift dynein to regulate anterograde intraflagellar transport), 揭示了在正向ift中,ift蛋白复合物如何同马达蛋白互作,从而保证ift机制的正常运行。
ift54是ift-b的一个组分,其具有n端的ch domain和c端的coiled-coil domain, 研究者发现,衣藻ift54在这两个结构域之间存在三段保守序列,其中261-275氨基酸片段的缺失抑制ift dynein进入纤毛,导致反向运输缺陷,引起ift蛋白复合物在纤毛顶端积累;而342-356氨基酸片断的缺失,则抑制ift的正向运输,导致ift蛋白复合物在纤毛基部的积累,同时显著影响纤毛的组装(见图例)。那么ift54的缺失突变所产生的性状是由于突变直接影响了其与马达蛋白的互作,还是影响了ift-b复合物的构象而间接起作用的呢?他们证明了ift54和kinesin-ii 以及ift dynein的组分d1blic直接互作,并且这种互作关系在人类细胞中是保守的。在后续的工作,需要分析ift54的结构,阐释其通过何种构像确保其同时和两个马达互作。本项工作的第一作者为朱欣博士和王介玲同学,通讯作者为潘俊敏教授;李淑芬博士和美国佐治亚大学的karl lechtreck教授也参与了研究工作。本研究得到了科技部,国家基金委,清华-北大生命中心、青岛国家海洋实验室以及美国nih的赞助。
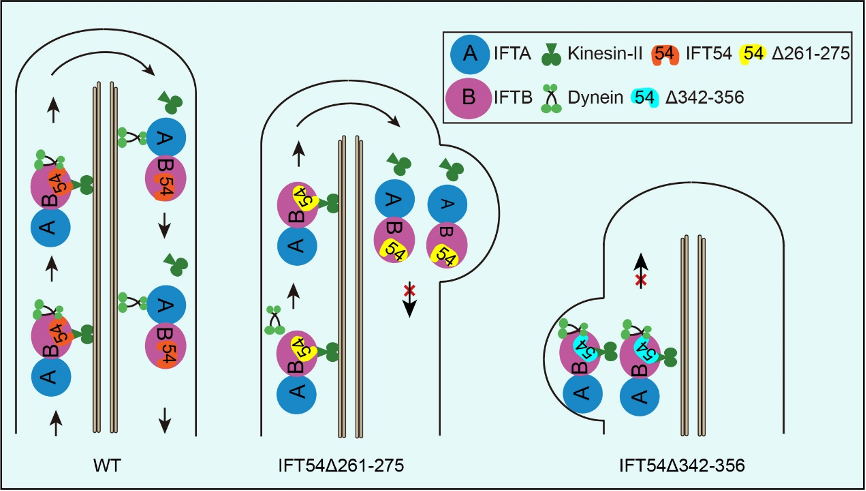
图例:ift54同驱动蛋白kinesin-ii 和ift dynein直接互作。kinesin-ii 负责ift的正向运输,即纤毛基部到顶端的运输;ift dynein参与ift的反向运输,即纤毛顶端到基部的运输。在ift的正向运输过程中,ift54与马达蛋白kinesin-ii和ift dynein同时互作,确保ift的正常进行。缺失ift54 261-275片段,ift dynein 不能同ift复合物结合,导致ift dynein不能进入纤毛,反向运输受阻,最终导致ift蛋白复合物在纤毛顶端积累;而缺失ift54 342-356片段干预kinesin-ii的运动,进而抑制ift的正向运输,导致ift蛋白复合物在纤毛基部积累,纤毛不能正常组装,形成极短的纤毛。
论文链接:https://www.embopress.org/doi/full/10.15252/embj.2020105781