2023年7月17日,清华大学生命科学学院颉伟研究组与宾夕法尼亚大学 richard m. schultz课题组合作,在《自然》期刊以长文形式报道了题为《obox调控小鼠合子基因组激活以及早期胚胎发育》(obox regulates murine zygotic genome activation and early development)的研究论文,该研究发现obox家族是调控小鼠合子基因组激活的关键转录因子,为哺乳动物合子基因组领域研究提供了新的研究方向,是该领域里的重要突破。
受精卵激活自身基因组是个体生命中的第一次转录事件,称为合子基因组激活(zygotic genome activation,zga)。刚受精的胚胎存在全基因组沉默的现象,之后子代逐渐脱离对母源因子的依赖,并在特定的发育时间点激活基因组来启动胚胎发育程序。2008年,科学家发现zelda是果蝇合子基因组关键启动因子。2013年研究人员发现nanog,soxb1和pou5f1是斑马鱼中关键转录因子。然而,哺乳动物中合子基因组启动关键转录因子长期以来一直不明确。2022年颉伟课题组和陈子江/赵涵课题组报道tprx是人类胚胎zga的重要转录因子(zou et al., science, 2022),然而该因子是否在不同物种中保守仍不清楚。
通过颉伟实验室前期开发的超灵敏早期胚胎翻译组学数据(xiong et al., nature cell biology, 2022)与开放染色质组学数据(wu et al., nature, 2016)的联合分析,研究者发现人类tprx家族在小鼠中的功能同源家族obox家族在卵母细胞、一细胞和二细胞胚胎中表达非常丰富,同时obox的结合序列(motif)在小鼠胚胎zga时期的开放染色质中高度富集,提示obox可能对小鼠zga具有重要功能。有趣的是,obox是有一个具有66个家族成员/拷贝的庞大家族。这个家族和tprx都来源于同一个祖先基因crx,但在小鼠和人中平行演化(maeso et al., 2016; wilming et al., 2015; zhong and holland, 2011)。通过构建obox敲除小鼠,研究者发现obox母源-合子纯和敲除(mzko)无法产生后代,胚胎阻滞在二到四细胞阶段。进一步研究发现obox mzko胚胎zga无法正常发生,在敲除胚胎中回补obox能够挽救zga和胚胎发育,证明obox是调控小鼠zga的必要转录因子。此外,在小鼠胚胎干细胞中过表达obox能够激活部分小鼠zga基因,证明obox是这些基因表达的充分条件。
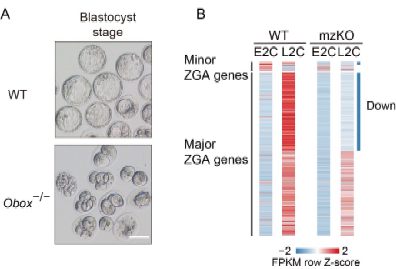
图1. obox家族敲除导致胚胎2-4细胞阻滞和合子基因组无法正常启动。
该研究进一步探索了obox是如何调控小鼠zga的。利用颉伟实验室开发的检测蛋白-dna相互作用的超灵敏测序技术stacc-seq (liu et al., nature, 2020),研究者发现obox比rna聚合酶ii更早定位在zga基因启动子或增强子上。同时rna聚合酶ii的“预配置”(pre-configuration)在obox mzko胚胎中无法正常进行,导致zga基因无法被正常激活。同时,部分基因被异常激活,提示obox在zga时期能够帮助rna聚合酶ii结合到正确靶基因上,保证zga正常进行。
图2. obox帮助rna聚合酶ii结合到正确靶基因上,保证zga正常进行。
综上所述,通过分析小鼠早期胚胎翻译组数据与开放染色质图谱,结合遗传学手段和一系列微量染色质检测技术,颉伟实验室和richard m. schultz实验室首次发现obox家族是调控小鼠合子基因组激活的核心因子,为哺乳动物zga领域研究打开新的大门。
清华大学颉伟教授与宾夕法尼亚大学richard m. schultz教授为本文的通讯作者,清华大学生命科学联合中心博士后嵇姝妍、陈凤玲,美国nih再生与发育生物学实验室研究员paula stein,清华大学生命科学联合中心2021级博士研究生王嘉程、周子茗以及颉伟实验室科研助理王利娟为共同第一作者。颉伟实验室赵晴(前科研秘书)和林自力(前博士后,现为北京农学院副教授)为共同第二作者。美国nih再生与发育生物学实验室资深研究员carmen j. williams为本研究提供了重要帮助。该课题得到了清华大学实验动物中心和清华大学生物计算中心的支持。该研究获得了国家自然科学基金会、国家科技部重点研发计划、清华-北京生命科学中心的经费支持。颉伟教授是hhmi国际研究学者和新基石研究员。