限制性内切酶是能够识别特异的dna序列,并将双链dna切割的一类酶,最早被发现于大肠杆菌体内,为细菌对抗病毒提供了一种防御机制。在分子克隆领域,内切酶长期被用于在体外组装dna双链片段。而多片段dna组装的可行性往往依赖于限制酶的识别、切割位点,例如目前应用广泛的golden gate assembly, 就利用了iis型内切酶的特点,可以在距离限制酶识别位点一定距离处切割dna,从而产生可编码的粘性末端。在分子克隆中,利用内切酶产生能够互补的粘性末端对于dna片段组装是必要的,因为互补粘性末端在dna纳米结构的自组装中也是不可或缺的,所以分子克隆的技巧在这方面的交叉应用是有广泛意义的。
基于这个思路,本研究探索了一种可控的dna纳米结构自组装系统。与golden gate assembly中多片段dna组装相似,iis型限制酶为dna纳米结构的连接创造特异的粘性末端,同时t4 dna连接酶巩固粘性末端的连接,从而实现dna纳米结构单元不同层级的自组装(图1)。
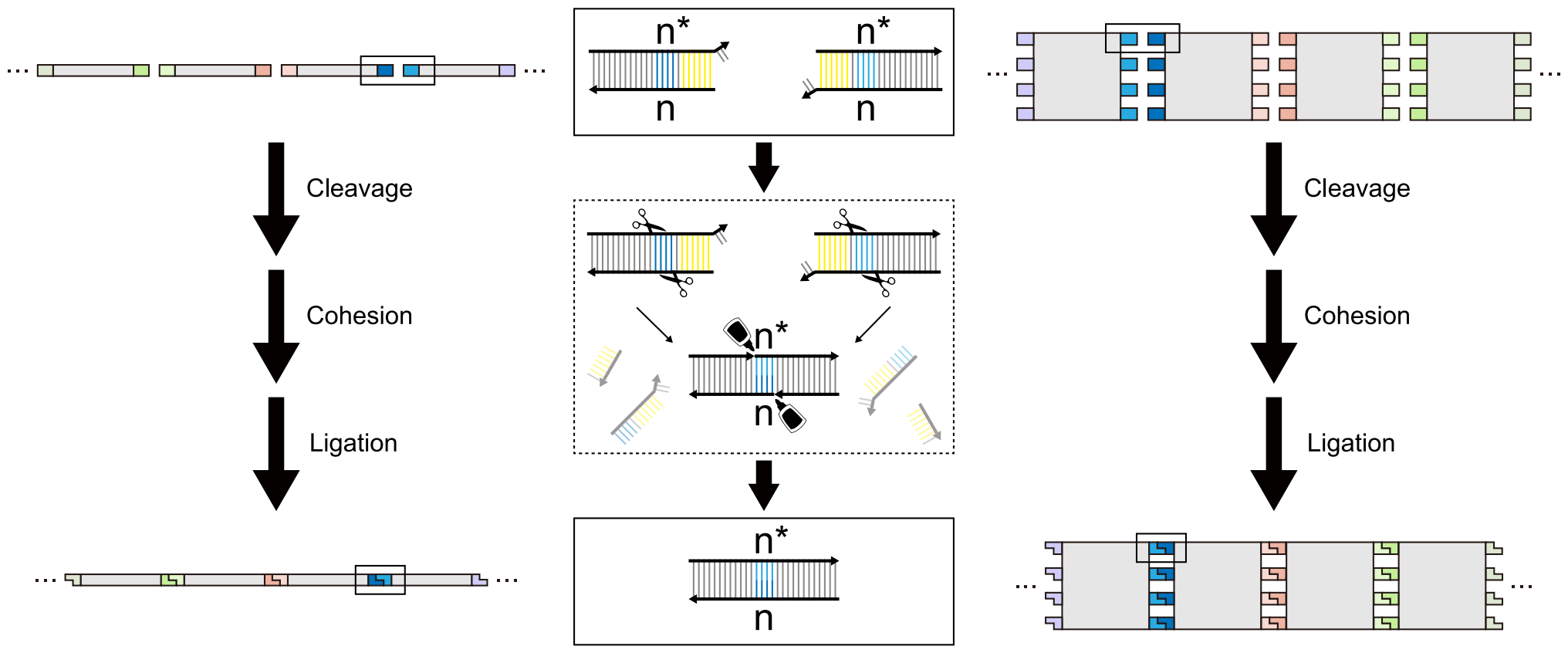
图1. golden gate assembly用于dna片段(左)和dna纳米结构(右)组装
利用iis型限制酶和t4 dna连接酶的特点,本研究实现了dna纳米结构的自环化、同源多聚体以及包括二聚体、三聚体、四聚体和五聚体在内的多种异源多聚体的组装(图2)。
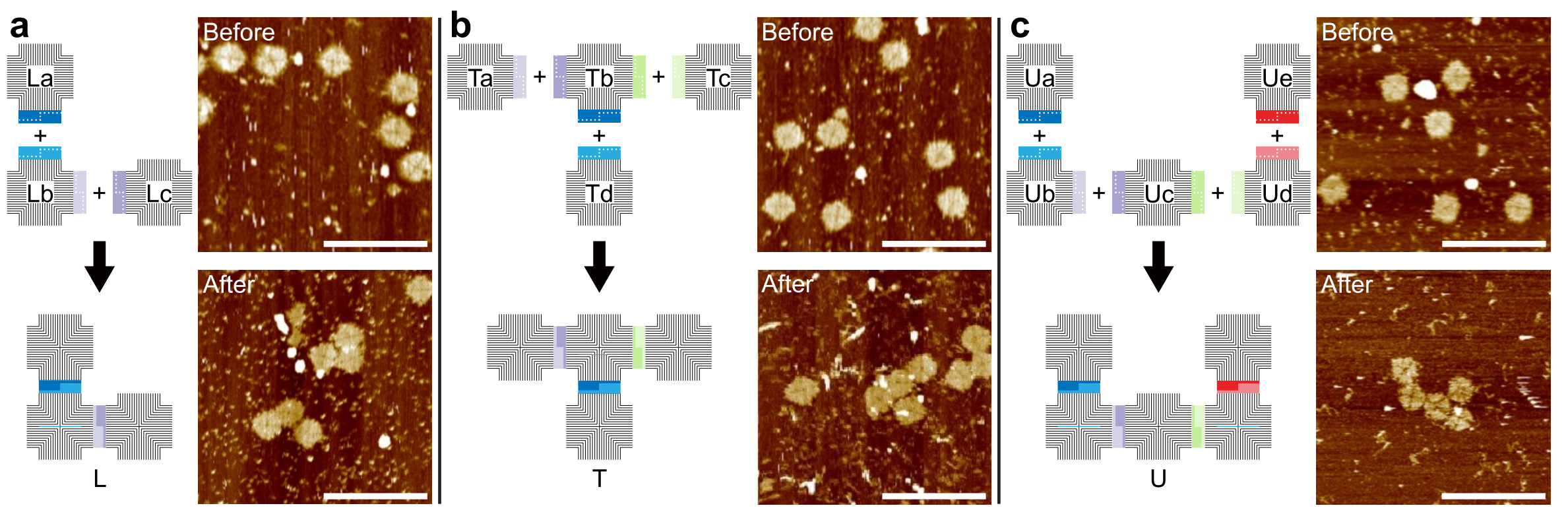
图2. golden gate assembly用于dna纳米结构异源多聚体组装。(a)三聚体l形,(b) 四聚体t形,(c)五聚体u形。
该研究成果由清华大学生命科学学院魏迪明分子设计课题组(madlab)完成,论文题目为“dna纳米结构的金门桥组装”(golden gate assembly of dna nanostructures),于2023年11月14日在线发表于《美国化学学会材料快报》(acs materials letters)。
清华大学生命科学学院本科毕业生张文远(现为清华大学医学院2022级博士研究生)和生命学院2018级博士生午红蕊为本文共同第一作者,魏迪明副教授为本文的通讯作者。该研究源于本科生课程《核酸纳米结构的分子设计》中的其中一个课程项目(张文远为该课程项目小组长)。该研究得到了科技部、国家自然科学基金委、清华大学春风基金等基金资助。
论文链接:https://pubs.acs.org/doi/10.1021/acsmaterialslett.3c01113