近二十年来,以protac为代表的蛋白质靶向降解技术(tpd)经历了飞速发展,被认为是最有可能解决难成药靶点的突破性技术之一。传统的protac技术通过利用e3泛素连接酶的催化作用,经由泛素-蛋白酶体途径对靶点进行特异性降解。然而,受限于有限可用的e3连接酶种类以及蛋白酶体的底物局限性,近年来涌现出多种基于溶酶体的tpd策略,例如靶向细胞膜蛋白或胞外蛋白的lytac技术、利用自噬途径降解固态聚集体或细胞器的attec和autotac技术等。这些技术的出现进一步推动了tpd领域的发展,并为多种重大疾病提供了潜在治疗策略。
随着“液-液相分离”领域的蓬勃发展,越来越多的研究表明,在降解过程中的关键蛋白会通过液-液相分离形成“降解凝聚体”,这些凝聚体扮演着降解工厂的角色,将与降解相关的功能蛋白及待降解的底物富集在局部区室中,从而高效发挥降解功能。其中最具代表性的降解凝聚体是自噬受体蛋白p62与多聚泛素链形成的p62小体,它们为隔离膜的附着和延伸提供支点,并启动随后的自噬进程(图1)。此外,p62还参与到泛素-蛋白酶体相关的降解凝聚体中,成为蛋白酶体和自噬途径之间的桥梁。如果能特异性地将蛋白靶点招募至这些降解凝聚体中,将可能摆脱酶促反应的催化步骤(例如e3泛素连接酶的催化反应),直接通过空间距离的拉近实现有效降解。
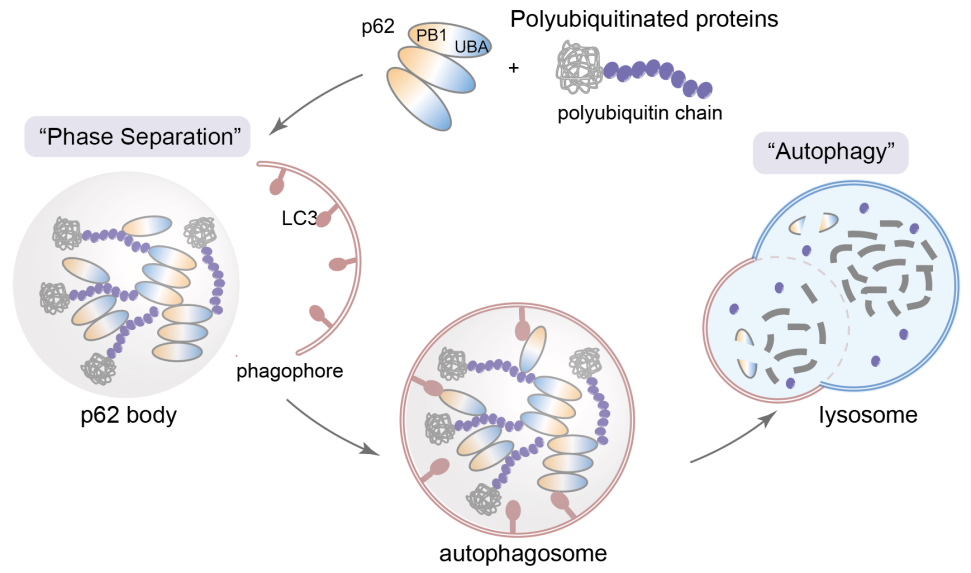
图1 p62降解凝聚体介导的自噬降解过程
2024年3月5日,清华大学生命学院李丕龙课题组和自然资源部第三海洋研究所李增鹏课题组在《细胞研究》cell research杂志合作发表了题为“一种由降解凝聚体所介导、利用桥接双特异性纳米抗体的一体化蛋白质靶向降解平台”(an all-in-one targeted protein degradation platform guided by degradation condensates-bridging bi-specific nanobodies)的研究论文,报道了一种新型蛋白质靶向降解技术pdf-bin,该技术的核心组分为一种能够同时结合p62蛋白和靶标蛋白的双特异性纳米抗体,它能够将靶蛋白特异性地招募至p62降解凝聚体中,从而实现靶向降解的功能(图2)。
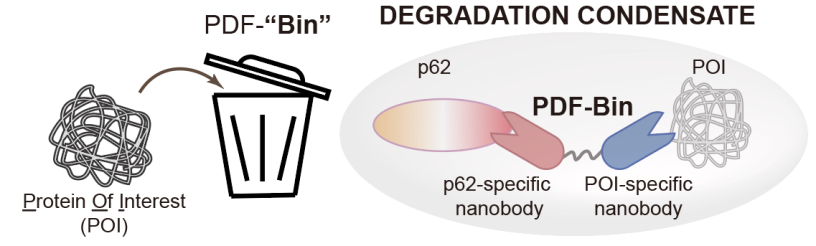
图2 pdf-bin示意图
pdf-bin取名自p62 degradation factory based on a bi-specific nanobody(基于双特异性纳米抗体的p62降解工厂),由特异性结合p62的纳米抗体(pn)、特异性结合靶标蛋白的纳米抗体和一段柔性连接子所构成。为了获得p62的纳米抗体,研究人员通过噬菌体展示技术联合显微成像共定位分析进行筛选,获得了3种特异性结合p62的纳米抗体(a1e、d9a和e12c)。将这3种pn分别融合egfp荧光标签的纳米抗体gn构建而成的pdf-bin(a1e-gn、d9a-gn和e12c-gn)均对egfp-tdp43蛋白具有较好的降解效果。
随后,研究人员选取了一系列融合有egfp标签的蛋白作为靶点,检测a1e-gn的降解能力。结果显示,a1e-gn对细胞核定位、细胞质定位、细胞膜定位以及发生固态聚集的靶蛋白均具有降解效果,证明pdf-bin具有较广的应用场景。
为了对pdf-bin的性质进行更进一步的探究,研究人员分别以egfp-tdp43以及内源性的stat3为靶点构建相应的pdf-bin融合蛋白。令人惊讶的是,pdf-bin对于egfp-tdp43的降解依赖蛋白酶体途径,而对于stat3的降解则是通过自噬-溶酶体途径进行。这一结果表明,pdf-bin会根据靶蛋白自身的特性,选择更适合的降解途径,从而更高效地实现降解效果(图3)。
最后,研究人员则对pdf-bin的疾病治疗潜力进行了初步探索。stat3蛋白作为肿瘤治疗中的经典靶点,在多种癌症中广泛激活并调控癌细胞的增殖和分化。通过在非小细胞肺癌细胞系中使用pdf-bin特异性地降解stat3蛋白,能够有效抑制肿瘤细胞的增殖和迁移,这为新型抗肿瘤药物的研发提供新的策略。
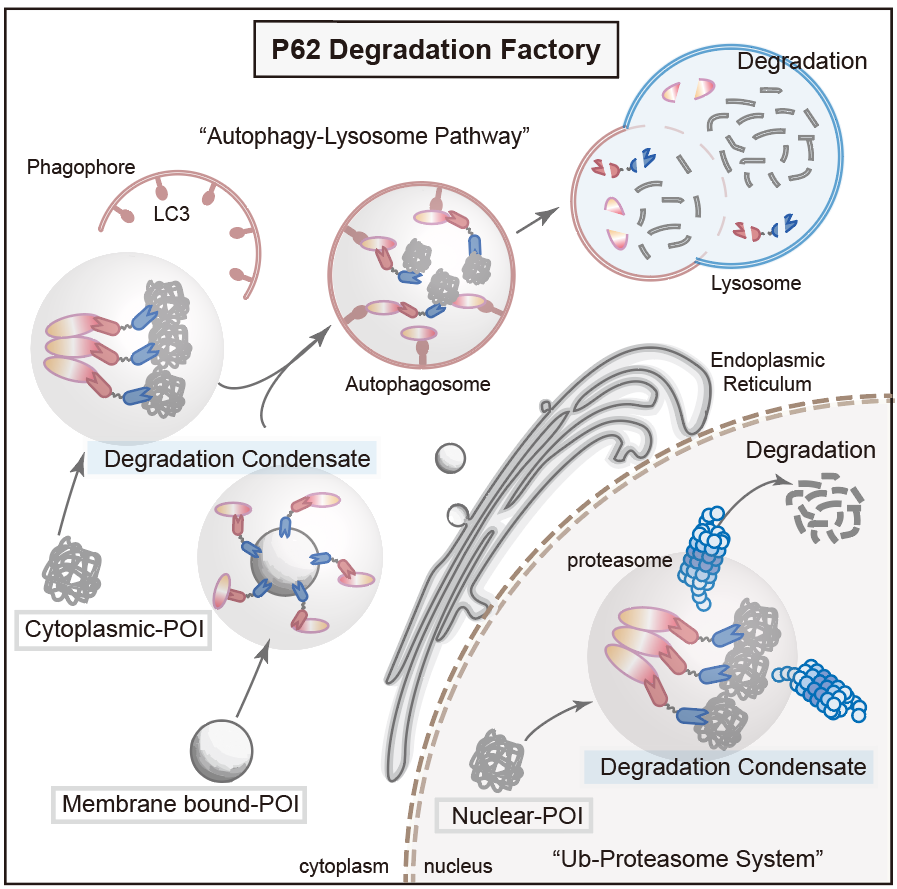
图3 pdf-bin降解机制示意图
综上所述,该研究开发了一种基于双特异性纳米抗体的蛋白质靶向降解策略,它对于多种亚细胞定位以及不同流动性的靶蛋白均具有降解效果,同时它能够整合泛素-蛋白酶体和自噬-溶酶体途径,根据靶蛋白的特性自主选择最优的降解途径。值得一提的是,基于纳米抗体的靶向策略相较于小分子化合物而言,具有更高的特异性和更强的结合力,因此可以降低脱靶的风险,但其具有更大的分子量,需要在后续的研究中引入和优化递送策略,才能更好地应用于动物水平的研究。
清华大学生命科学学院李丕龙副教授和自然资源部第三海洋研究所李增鹏研究员为本文通讯作者;清华大学生命科学学院2020级博士生贾雯为本文第一作者,自然资源部第三海洋研究所2021级硕士生李伟杰为本研究工作做出重要贡献。本研究获得国家自然科学基金委原创探索计划项目的大力支持。