膜融合是细胞内最重要的生命活动之一。保守的snare家族蛋白通过形成高度稳定的snare复合体介导膜融合。snare复合体必须被解聚成单体以便循环使用,而这依赖于atp酶nsf蛋白。nsf通过适配蛋白snap与snare复合体结合形成20s复合体,随后水解atp产生能量将snare复合体解聚。自1998年科学家发现nsf以来,nsf解聚snare复合体的工作机制一直是研究热点。虽然已有20s复合体的结构,但由于缺少解聚中间态的信息,snare复合体解聚的机制依旧不清楚。
2025年1月2日,清华大学生命科学学院隋森芳课题组与陈春来课题组合作,在《自然通讯》(nature communications)杂志发表了题目为“单分子双色和三色fret研究揭示了nsf解聚snare复合体过程中的过渡态(single-molecule two- and three-colour fret studies reveal a transition state in snare disassembly by nsf)”的研究论文,澄清了snare解聚的顺序问题。
研究人员首次利用单分子三色fret技术在接近生理环境(即膜存在的条件)下监测nsf解聚snare复合体的过程,这一实验方案在硬件、生化样品制备和数据处理方面都极具挑战性。通过biotin标记的磷脂组装的纳米盘将snare复合体固定在玻片上,组成snare复合体的三个蛋白(syntaxin、vamp和snap25)分别标记上cy3、cy5和cy7荧光染料,基于研究人员的设计,在所有三个fret对之间都有很高的fret效率。随后加入nsf、a-snap、atp、mg2 启动反应,同时使用全内反射显微镜记录荧光信号,根据信号的轨迹获取动态信息(图1)。基于方法上的进步,以及同时捕获三个蛋白运动的精妙实验设计,研究人员能够捕捉到比早先报道更丰富的信息。他们观察到snare复合体的解聚存在两条主要路径。一条路径是syntaxin首先以可观察到的瞬时状态在n端与复合物的其余部分分离,然后完全解离。另一条路径是vamp首先与syntaxin和snap25解离(图2)。这个实验结果澄清了领域内的一个重要问题,即snare复合体的解聚主要是一个依次解离的过程,而不是以前报道的同时解离的方式。

图1. 单分子三色fret实验流程示意图(a)和典型的荧光轨迹(b和c)
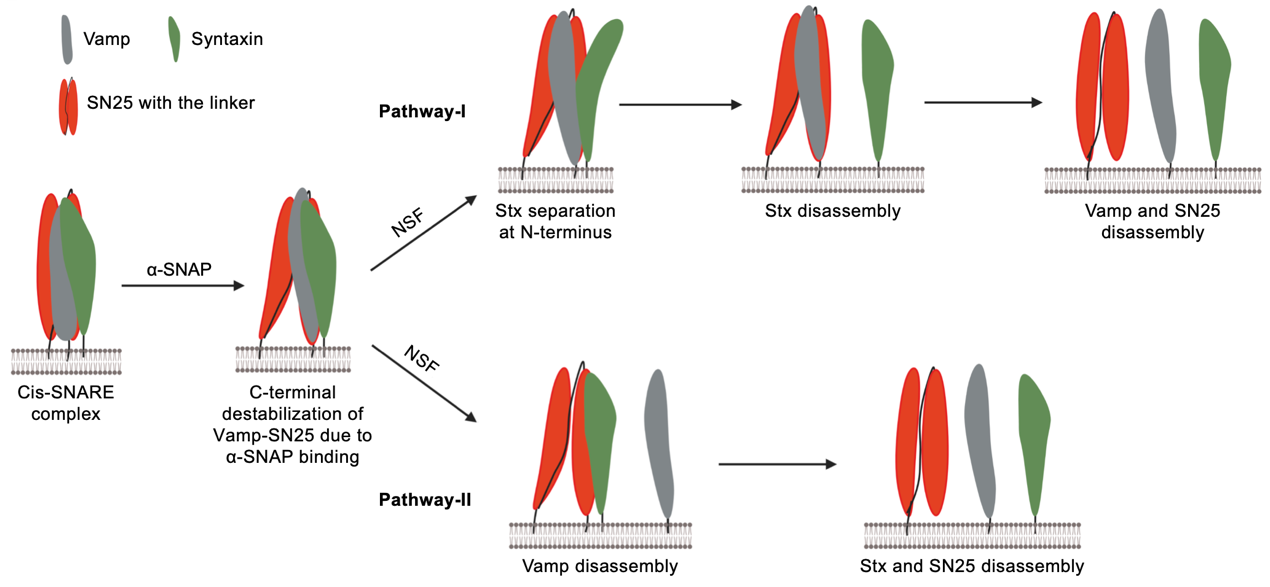
图2. nsf解聚snare复合体的两条主要路径示意图
清华大学生命科学学院隋森芳教授、陈春来副教授和孙珊副研究员为本文共同通讯作者。清华大学生命科学学院已出站博士后sudheer k. cheppali、2019级博士生李畅、2018级博士生邢文婧(已毕业)为本文共同一作。本项目获得了国家自然科学基金委、国家重点研发计划、北京生物结构前沿研究中心、膜生物学国家重点实验室等的经费资助。
原文链接: